

La nouvelle génération d’échographes de fertilité ImaGo a été lancée aujourd’hui avec l’ImaGo L/C et l’ImaGo Flex.
Plus d'informations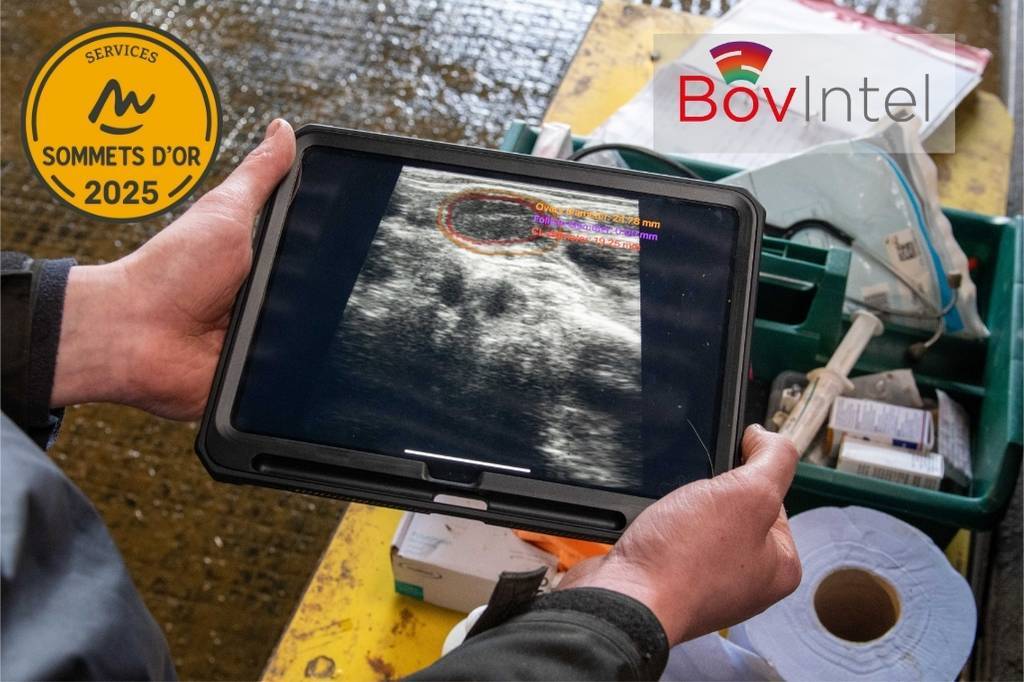
IMV Technologies a remporté le Sommet d’Or 2025 pour BovIntel, son outil d’aide à la décision en reproduction. Intégré à l’Easi-Scan:Go, il optimise en temps réel les performances des troupeaux.
Plus d'informations
Votre avis vraiment !
Chez IMV Technologies, votre opinion est essentielle. Que vous soyez vétérinaire, éleveur, entreprise de génétique, partenaire pharmaceutique ou membre d’un centre d’insémination artificielle, nous souhaitons vous entendre !

Le Groupe IMV Technologies annonce un changement à la tête de son entreprise : à compter du 1er avril 2025, Oliver Kohlhaas prend la succession d’Alain de Lambilly en tant que Président du Directoire du Groupe IMV Technologies.

🐟 Vous participez à Aquaculture America 2025 à La Nouvelle-Orléans ?

IMV Technologies SAS publie son indicateur d’égalité salariale femmes / hommes en réponse à la loi « Avenir Professionnel » du 05 septembre 2018.
Plus d'informations
IMV Technologies annonce aujourd’hui que Conception Ro-Main Inc. (Ro-Main), un acteur majeur dans le développement de solutions technologiques pour les éleveurs porcins, basé au Québec (Canada), intégrera prochainement la division Farm Animal du groupe IMV Technologies.
Plus d'informations
Nous sommes très heureux d'annoncer l'acquisition de Medivet Scandinavian AB par le groupe IMV Technologies.
Plus d'informations
Une première mondiale dans le domaine de l'imagerie échographique bovine s'annonce prometteuse pour accroître la productivité et la rentabilité des exploitations laitières, en offrant un accès amélioré aux informations sur la fertilité.
Plus d'informations
IMV Technologies SAS publie son indicateur d’égalité salariale femmes / hommes en réponse à la loi « Avenir Professionnel » du 05 septembre 2018.
Plus d'informations
31 mai 2023, L'Aigle, France- IMV Technologies a le plaisir d'annoncer l'acquisition de Veterinary Solutions, un leader dans le développement de systèmes de radiographie numérique vétérinaire (DR X-Ray) et de logiciels de gestion électronique des images médicales avec fonctions d'archivage, de stockage et de communication rapide (PACS), basé en Belgique.
Veterinary Solutions rejoindra le secteur des animaux de compagnie du groupe IMV Technologies.
Plus d'informations
Nous sommes heureux d'annoncer le lancement de notre nouvelle génération de solution d’impression pour paillettes, IRIS Compact, dotée de caractéristiques et de performances de pointe.
Plus d'informations
Indicateur Egalité salariale femmes / hommes
Plus d'informations
Le SPACE fête ses 35 ans et IMV Technologies est au rendez-vous pour participer de cette célébration !
Plus d'informations
IMV TECHNOLOGIES SA OBTIENT 86/100 A L’INDEX D’EGALITE FEMMES-HOMMES
Plus d'informations
Le 28 janvier 2022, L'Aigle, France - IMV Technologies a annoncé aujourd'hui l'acquisition de VES Custom Optics (VESCO), une société de pointe spécialisée dans l'endoscopie vétérinaire basée au Royaume-Uni.
Plus d'informations
L’Aigle, France, 29 avril 2021– IMV Technologies, leader dans le domaine des solutions de reproduction assistée et de l’imagerie vétérinaire, a le plaisir d’annoncer qu’il a rejoint les sociétés du portefeuille de Montagu Private Equity.
Plus d'informations
Paris, le 20 janvier 2021 – Montagu Private Equity (« Montagu »), un des principaux acteurs du marché européen du capital investissement, annonce avoir trouvé un accord avec Qualium Investissement et l’équipe dirigeante en vue de l'acquisition d’IMV Technologies.
Plus d'informations
L'Aigle, France, 21 décembre 2020.- IMV Technologies a finalisé avec succès l'acquisition de Tecnovet, SL, une société espagnole spécialisée dans la technologie d'insémination artificielle porcine et d'autres produits vétérinaires. Tecnovet est reconnu dans le monde entier pour sa gamme Import-vet de produits d'insémination porcine.
Plus d'informations
Grâce à l'utilisation de webinaires, nos collègues internationaux, nos partenaires de vente, et nos clients ont tiré parti de l'apprentissage à distance pour suivre des sessions de formation pédagogique et technique.
Plus d'informations
Après une pause temporaire, IMV Technologies a redémarré son blog. Les employés d’IMV Technologies, et dans certain cas d’autres leaders d'opinion clés utiliseront les entrées de blog pour parler directement aux partenaires et aux clients d’IMV Technologies au sujet de produits, de sociétés et d’actualités.
Plus d'informations

IMV Technologies, leader mondial des biotechnologies de la reproduction assistée, annonce la nomination de Mr. Alain de Lambilly au poste de PDG du groupe IMV Technologies, à compter du 6 janvier 2020.
Plus d'informations
De l'apprentissage, du partage, de l'entrainement mais également des moments de détente durant ce séminaire d'analyse chez IMV à L'Aigle.
Plus d'informations
Des clients de toute l'Asie sont venus assister à la présentation d'IMV sur les toutes dernières technologies en matière de reproduction porcine.
Plus d'informations
Agnes Camus Duquesne, notre technicienne experte en reproduction animale, a installé un CEROS II à Teagasc Grande en Irlande.
Plus d'informations
400 professionnels, techniciens et vétérinaires spécialisés dans la reproduction bovine ont assisté à la 8ème conférence bovine internationale organisée par Humeco et IMV à Huesca en Espagne.
Plus d'informations
Nous étions heureux d'accueillir nos clients à l'Aigle cette semaine pour notre troisième séminaire sur l'analyse de la semence.
Plus d'informations
Quelques photos de notre premier atelier et séminaire sur la reproduction bovine en Afrique.
Plus d'informations
Ce centre de transfert de gènes (CTG) de 300 têtes est équipé des dernières technologies et est entièrement alimenté par des panneaux solaires.
Plus d'informations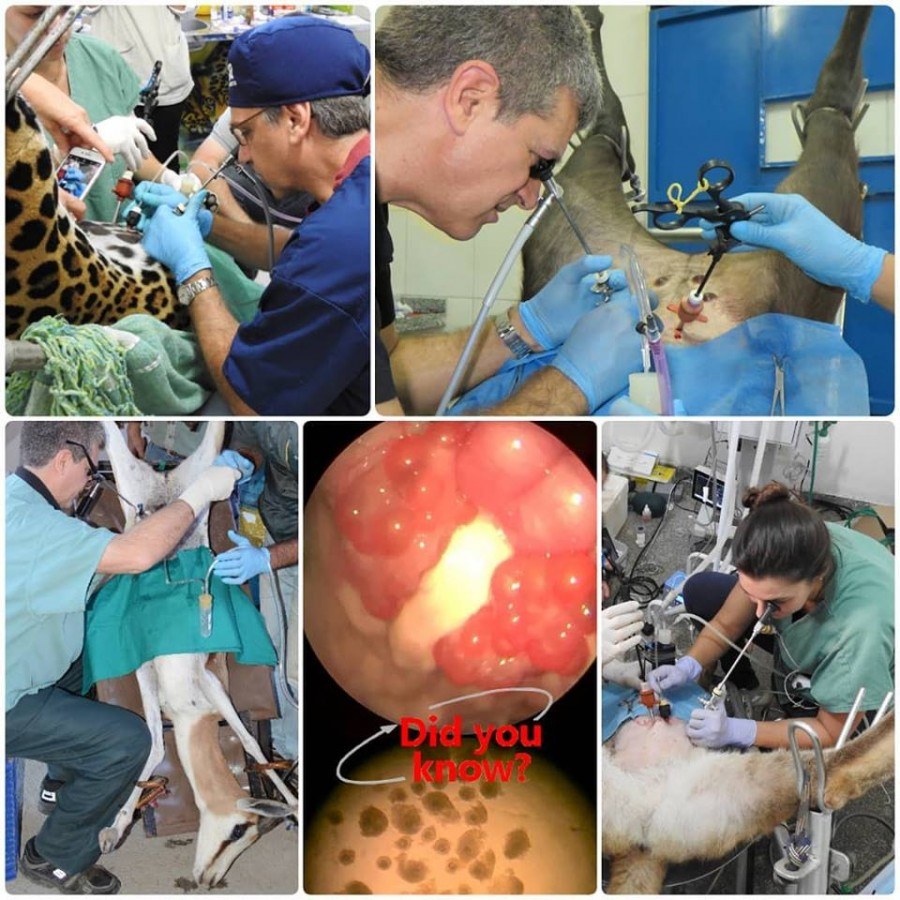
L'aspiration folliculaire par laparoscopie est une technique mise au point par le professeur Hernan Baldassarre chez les petits ruminants pour la production in vitro d'embryons.
Plus d'informations
Une bonne semaine de formation avec l'équipe Labora.
Plus d'informations

Pensé par une équipe d'experts en insémination et ergonomie, ce banc facilite l'insémination en améliorant le bien-être de l'animal, comme de l'humain.
Plus d'informations
Villa Maria a été l'épicentre du secteur de la reproduction porcine argentine cette semaine. En effet, IMV Technologies a organisé son premier séminaire sur la reproduction porcine en Argentine, en partenariat avec Productores Agroganaderos.
Plus d'informations
IMV Technologies, en partenariat avec Productos Agroganaderos, présenteront leur gamme de produits dédiés à la reproduction porcine les 3 et 4 juillet prochain en Argentine.
Plus d'informations
La loi a changé.
Plus d'informations
Les équipes d'IMV Technologies Chine, Inde et France étaient présentes à la formation CASA dispensée par Hamilton Thorne en Thaïlande.
Plus d'informations
Après une conférence réussie en Russie avec IMV, Ceva Santé Animal et PIC UK, notre disributeur exclusif, Українські ветеринарні технології a appliqué le même concept en Ukraine.
Plus d'informations
Trier uniquement les œufs de meilleure qualité est désormais obligatoire dans l'industrie des salmonidés. Nous sommes fiers que Benchmark ait choisi notre solution pour trier tous ses œufs de saumon atlantique.
Plus d'informations
INRA96 est un milieu de conservation pour la semence fraîche équine qui améliore la préservation et maintien la fertilité jusqu'à 48 heures.
Plus d'informations
Toute l'équipe IMV vous souhaite de joyeuses fêtes de fin d'année !
Plus d'informations
Aujourd'hui, des clients de différentes nationalités se sont déplacés à L'Aigle pour assister au séminaire "how to manage semen analysis in a production lab".
Plus d'informations
BactiBag® est notre toute dernière innovation pour le packaging de la semence porcine, répondant au challenge du contrôle de la contamination bactérienne dans la semence.
Plus d'informations
ISevo, notre nouvelle plateforme pour le conditionnement de la semence en paillettes a été lancé la semaine dernière.
Plus d'informations
Lancement de l'ISevo 2017 : un succès !
Plus d'informations
Humeco et IMV ont organisé la 7ème édition de la Conférence Internationale sur la Reproduction Porcine, qui s'est déroulée le 4 octobre dernier à Huesca en Espagne.
Plus d'informations
La cérémonie des "Sommets d'Or" récompense les exposants présentant des équipements, des produits ou des services innovants quant à leur production, leurs caractéristiques sécurité ou encore leur ergonomie.
Plus d'informations
AlphaVision, GTB V3, IVOS II, GoldenFilled, Collectis, les scanners ECM et MRA seront également présents.
Plus d'informations


Retrouver l'équipe IMV à la foire de Libramont ! Une grande foire agricole, forestière et agroalimentaire en plein air.
Plus d'informationsAlphaVision a remporté le prix de la catégorie "Supply" à la cérémonie des Sommets d'Or 2017 !
Plus d'informations
Le groupe français IMV Technologies annonce l’acquisition d’ECM (Echo Control Medical), l’un des leaders mondiaux de la conception et fabrication d’échographes portables et ultra-portables pour les animaux d’élevage et de compagnie.
Plus d'informations
IMV et Humeco ont participé à FIGAN 2017 (International Fair for Animal Production) qui s'st déroulé à la Feria de Zaragoza en mars dernier.
Plus d'informations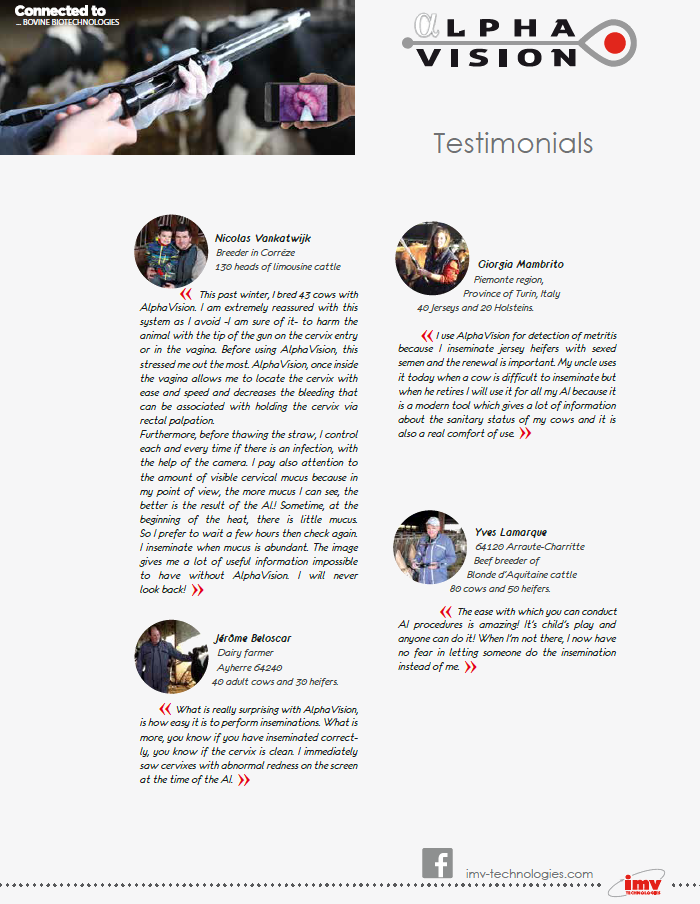
Témoignages AlphaVision
Plus d'informations
In a recent interview, Jos Mottershead, owner of Equine-Reproduction.com, LLC, explained some of the key components breeders need to be prepared for the upcoming breeding season. As part of this discussion, Jos mentions several important products and equipment, provided by IMV, that are a critical component for breeders to have on hand.
Plus d'informations
Milk-based semen diluents have proven to be practical and effective in protecting sperm cells during storage prior to artificial insemination; however, milk components may not be at optimal concentrations, and some may even be detrimental to sperm cells.
Plus d'informations
Un témoignage sur l'AlphaVision de Jérôme Beloscar, fermier en France.
Plus d'informations
Grâce à vous, notre page a atteint 1,000 j'aime !
Plus d'informations
Come and take part in the theoretical & practical course: “Innovations and new applications of muscle-skeletal, visceral and reproductive ultrasounds for bovines” (in Spanish only)!
Plus d'informationsIMV vous remercie de votre présence et de votre fidélité au cours de l'année 2016. Cela a été un immense plaisir que de vous aider à atteindre vos objectifs. Nous espérons pouvoir vous servir de nouveau pour cette nouvelle année. Très bonnes fêtes à tous.
Plus d'informations
En proposant une gamme de trieurs d’œufs, d’outils d’optimisation de la reproduction et de la cryopréservation, IMV Technologies met à disposition de ses clients un saut technologique vers l’élevage de précision.
Plus d'informations
Restez informé sur les dernières technologies développées en matière de reproduction bovine ! La conférence se tiendra à Huesca (Espagne) les 9 et 10 novembre
Plus d'informations


Esprit d'équipe et Responsabilité Sociétale des Entreprises amplifié pendant le WPE!
Plus d'informations
Vous êtes à la recherche d'une entreprise dynamique et internationale?
Plus d'informations
IMV et son nouveau distributeur en Russie - Kramp, ont organisé un séminaire sur la reproduction porcine à Belgorod qui a rassemblé plus de 10 grands producteurs porcins russes.
Plus d'informations
IMV connaît l'importance du progrès. Voilà pourquoi nous sommes un sponsor majeur du 18e Congrès international de la reproduction animale ICAR.
Plus d'informations
Nos toutes nouvelles plaques Easykit vont vous simplifier la vie
Plus d'informations
Viking Genetics est une des plus grandes entreprises d'élevage au monde regroupant 30.000 agriculteurs. VikingGenetics utilise les dernières technologies pour produire plus de 4 millions de paillettes annuelle dans 4 laboratoires situés dans 3 pays scandinaves. La semence de VikingGenetics est vendue dans plus de 50 pays.
Plus d'informations
Sans jaune d’œuf, ni lait, ni lécithine – OptiXcell est produit à base de liposome et sans protéine, ce qui garantit une meilleure qualité de dilution.
Plus d'informations